近日,国际权威期刊Advanced Materials(IF:29.4)在线发表我校3499cc拉斯维加斯入口王伟教授团队的最新研究论文:Extracellular Vesicles-Derived Hybrid Nanoplatforms for Amplified CD47 Blockade-Based Cancer Immunotherapy。我校3499cc拉斯维加斯入口王伟教授、国家纳米科学中心梁兴杰教授为本文共同通讯作者,我校为本文第一完成单位。
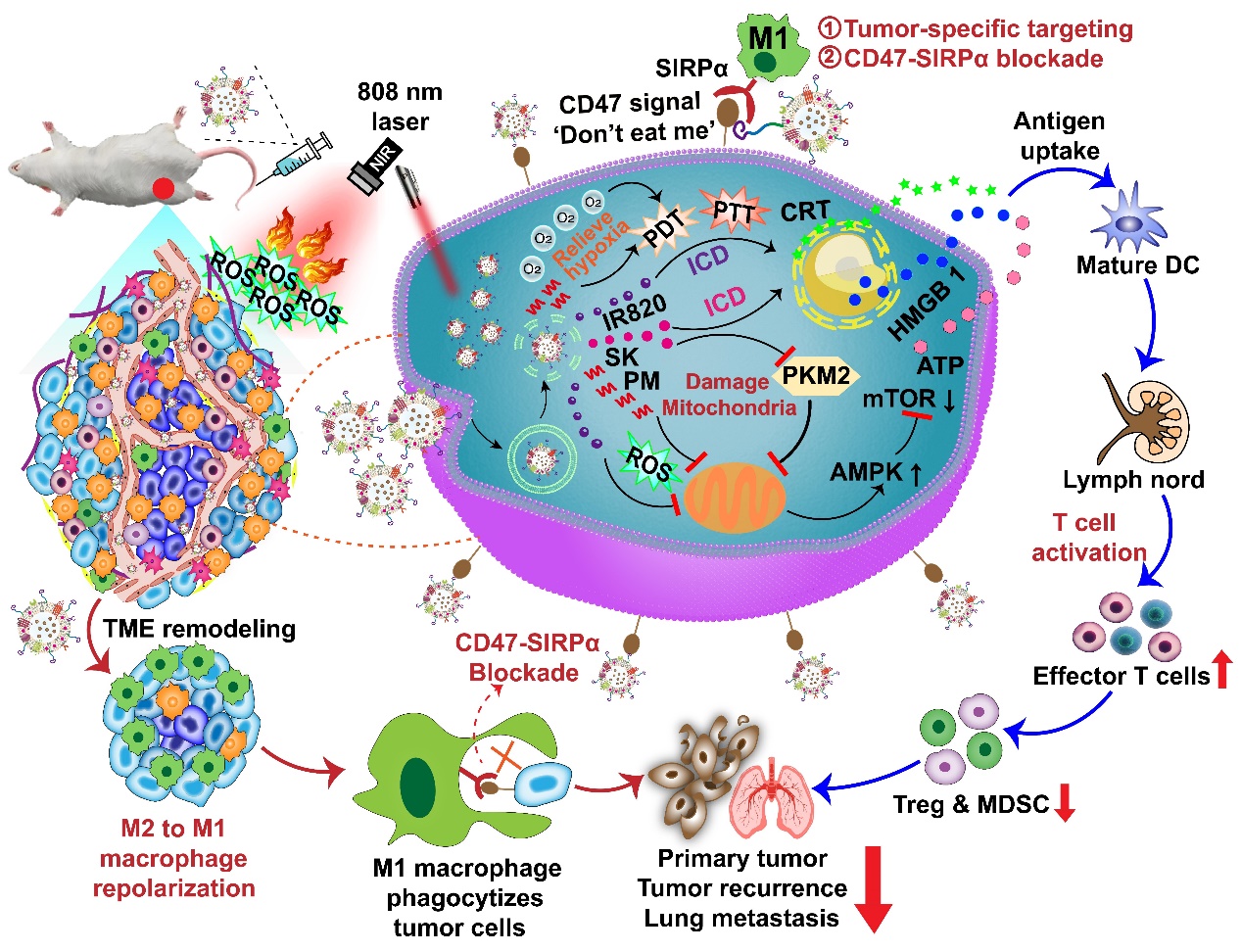
免疫检查点阻断疗法(ICBT)已成为一种具有巨大发展潜力的肿瘤免疫疗法,但ICBT仍存在临床响应性低等局限性,因为肿瘤微环境严重削弱了ICBT对免疫学“冷”肿瘤的治疗效果。“冷”肿瘤微环境中缺乏细胞毒T细胞的瘤内浸润,含有大量具有促肿瘤生长作用的巨噬细胞、抗炎细胞因子和免疫抑制细胞(如调节性T细胞、髓源性抑制细胞等),导致无效的抗肿瘤免疫治疗。肿瘤相关巨噬细胞(TAMs)是浸润到肿瘤组织中最丰富的免疫细胞,在调节抗肿瘤免疫方面发挥关键作用。TAMs能分化成两种相反功能的表型,一种是促炎杀肿瘤的M1表型,另一种是抗炎促肿瘤的M2表型。M1型TAMs是典型的活化巨噬细胞,其具有肿瘤抑制能力,而M2型TAMs具有促肿瘤作用而导致肿瘤发展和免疫抑制。TAMs具有可塑性,促肿瘤的M2型TAMs能够被极化为抗肿瘤的M1型TAMs,这有助于将“冷”肿瘤微环境转变为“热”肿瘤微环境,从而进行有效的肿瘤免疫治疗。然而,仅依靠M1型TAMs对肿瘤细胞的吞噬还不足以诱导有效的肿瘤抑制,因为其吞噬功能经常会被肿瘤细胞释放的“别吃我”信号所阻碍。肿瘤细胞表面过表达的CD47分子可与巨噬细胞表面的SIRP𝛼受体结合,使得肿瘤细胞发出“别吃我”信号而逃避巨噬细胞吞噬。因此,阻断CD47-SIRP𝛼轴和重塑TAMs为抗肿瘤表型是两种增强肿瘤免疫治疗的有效手段。
王伟教授团队构建了一种来源于M1型TAMs细胞外囊泡、RS17肽(一种与肿瘤细胞上CD47特异性结合并阻断CD47-SIRPα信号传导的抗肿瘤肽)修饰的杂化纳米递药载体(hEL-RS17),该载体可主动靶向肿瘤细胞并重塑TAMs表型。由于CD47被阻断,更多的M1型TAMs浸润到肿瘤组织以吞噬更多的肿瘤细胞。通过进一步将化疗药、光敏剂和免疫调节剂共包埋于hEL-RS17中,该杂化纳米递药平台(SPI@hEL-RS17)凭借各组分的密切协同,同时联合多种治疗模式,展现出了增强的抗肿瘤效果。在激光照射下,SPI@hEL-RS17纳米颗粒对4T1乳腺肿瘤和B16F10黑色素瘤模型均表现出强大的抗肿瘤疗效,不仅抑制了原发性肿瘤生长,而且还建立了长期免疫记忆,抑制了肿瘤的转移和复发。因此,该研究在基于CD47阻断的抗肿瘤免疫治疗方面展现出良好的应用潜力。
以上工作得到了国家自然科学基金项目、江苏省六大人才高峰和333高层次人才项目以及我校双一流建设项目等项目的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202303835
示意图
(供稿单位:3499cc拉斯维加斯入口,撰写人:刘华)





